1.Menurut Louis
de Broglie bahwa elektron mempunyai sifat gelombang sekaligus juga partikel.
Jelaskan keterkaitannya dengan teori mekanika kuantum dan Teori Orbital Molekul
?
Menurut de Broglie, elektron dapat
bersifat sebagai partikel dan juga sebagai gelombang. Adanya sifat gelombang
dari elektron ini menunjukkan bahwa elektron sebenarnya tidak bergerak dalam
lintasan dengan tingkat energi tertentu, melainkan tersebar di dalam ruang
atom.
Gagasan ini adalah timbal balik daripada gagasan partikel cahaya yang
dikemukakan Max Planck. Louis de Broglie meneliti keberadaan gelombang melalui
eksperimen difraksi berkas elektron. Dari hasil penelitiannya inilah diusulkan
“materi mempunyai sifat gelombang di samping partikel”, yang dikenal dengan
prinsip dualitas.
- menurut Heisenberg, tidak mungkin menentukan kecepatan dan posisi elektron secara bersamaan, tetapi yang dapat ditentukan hanyalah kebolehjadian menemukan elektron pada jarak tertentu dari inti.
Erwin Schrodinger mengajukan teori yang disebut teori
atom mekanika kuantum ”Kedudukan elektron dalam atom tidak dapat ditentukan
dengan pasti yang dapat ditentukan adalah kemungkinan menemukna elektron
sebagai fungsi jarak dari inti atom”.
Daerah dangan kemungkinan terbesar ditemukan elektron
disebut orbital. Orbital digambarkan berupa awan, yang tebal tipisnya
menyatakan besar kecilnya kemungkinan ditemukan elektron di daerah tersebut.
Kemudian Werner Heisenberg mengemukakan bahwa metode eksperimen yang digunakan
untuk menemukan posisi atau momentum suatu partikel seperti elektron dapat
menyebabkan perubahan, baik pada posisi, momentum atau keduanya.
Teori Schrodinger dan prinsip ketidakpastian
Heisenberg melahirkan model atom mekanika kuantum sebagai berikut:
1 Posisi elektron dalam atom tidak dapat ditentukan
dengan past
2. Atom mempunyai kulit elektron.
3. Setiap kulit elektron memiliki subkulit elektron.
4. Setiap subkulit elektron memiliki sub-sub kulit
elektron.
Pada musim panas 1923, de Broglie menyatakan, "secara tiba-tiba muncul gagasan untuk memperluas perilaku rangkap (dua) cahaya mencangkup pula alam partikel". Ia kemudian memberanikan diri dengan mengemukakan bahwa "partikel, seperti elektron juga berperilaku sebagai gelombang". Gagasannya ini ia tuangkan dalam tiga makalah ringkas yang diterbitkan pada 1924; salah satunya dalam jurnal vak fisika Perancis, Comptes Rendus.
Penyajiannya secara terinci dan lebih luas kemudian menjadi bahan tesis doktoralnya yang ia pertahankan pada November 1924 di Sorbonne, Paris. Tesis ini berangkat dari dua persamaan yang telah dirumuskan Einstein untuk foton,
Penyajiannya secara terinci dan lebih luas kemudian menjadi bahan tesis doktoralnya yang ia pertahankan pada November 1924 di Sorbonne, Paris. Tesis ini berangkat dari dua persamaan yang telah dirumuskan Einstein untuk foton,
Teori orbital molekul adalah teori yang
menjelaskan ikatan kimia melalui diagram orbital molekul. sifat magnet dan
sifat-sifat molekul dapat dengan mudah dijelaskan dengan menggunakan pendekatan
mekanika kuantum lain yang disebut dengan teori orbital molekul. salah satu
contoh nya teori orbital molekul menjelaskan sifat paramagtenisme dari molekul
O2. Teori ini menggambarkan ikatan konvalen melalui istilah orbital
molekul yang dihasilkan dari interaksi orbital atom dari atom yang berikatan
dengan molekul secara keseluruhan.
Jadi Keterkaitan antara teori mekanika kuantum dengan teori orbital
molekul itu adalah kedua teori dapat digunakan dalam penjelasan
sifat magnet dan sifat molekul. Teori orbital molekul merupakan pendekatan lain
dari teori mekanika kuantum.
2.Bila absorpsi sinar UV oleh ikatan rangkap menghasilkan promosi elektron ke orbital yang berenergi lebih tinggi. Transisi elektron manakah memerlukan energi terkecil bila sikloheksena berpindah ke tingkat tereksitasi ?
Energi yang dimiliki sinar UV mampu menyebabkan perpindahan elektron (promosi elektron) atau yang disebut transisi elektronik. Transisi elektronik dapat diartikan sebagai perpindahan elektron dari satu orbital ke orbital yang lain.
Pada transisi elektronik inti-inti atom dapat dianggap berada pada posisi yang tepat. Hal ini dikenal dengan prinsip Franck-Condon. Disamping itu dalam proses transisi ini tidak semua elektron ikatan terpromosikan ke orbital antiikatan.
Berdasarkan jenis orbital tersebut maka, jenis-jenis transisi elektronik dibedakan menjadi empat macam, yakni:
1) Transisi σ → σ*
2) Transisi π → π*
3) Transisi n → π*
4) Transisi n → σ*
Keterangan
· σ : senyawa-senyawa yang memiliki ikatan tunggal
· π : senyawa-senyawa yang memiliki ikatan rangkap
· n menyatakan orbital non-ikatan: untuk senyawa-senyawa yang memiliki elektron bebas.
· σ* dan π* merupakan orbital yang kosong (tanpa elektron), orbital ini akan terisi elektron ketika telah atau bila terjadi eksitasi elektron atau perpindahan elektron atau promosi elektron dari orbital ikatan.
Energi yang diperlukan untuk menyebabkan terjadinya transisi berbeda antara transisi satu dengan transisi yang lain. Transisi σ ke σ* memerlukan energi paling besar, sedangkan energi terkecil diperlukan untuk transisi dari n ke π.
Untuk memberikan gambaran dan memudahkan pemahaman tentang jenis transisi beserta perbandingan energi yang diperlukan dapat dilihat pada gambar berikut:

Pada setiap jenis transisi elektronik yang terjadi, terdapat karakter dan melibatkan energi yang berbeda. Suatu kromofor dengan pasangan elektron bebas (n) dapat menjalani transisi dari orbital non-ikatan (n) ke orbital anti-ikatan, baik pada obital sigma bintang (α*) maupun phi bintang(π*). Sedangkan, kromofor dengan elektron ikatan rangap (menghuni orbital phi) akan menjalani transisi dari orbital π ke orbital π*. Demikian seterusnya untuk jenis transisi yang lain.
Dalam penentuan struktur molekul, tansisi σ → σ* tidak begitu penting karena puncak absorbsi berada pada daerah ultraviolet vakum yang berarti tidak terukur oleh peralatan atau instrumen pada umumnya. Walaupun transisi π→π* pada ikatan ganda terisolasi mempunyai puncak absorbsi di daerah UV vakum tetapi transisi π→π* tergantung pada konjugasi ikatan ganda dengan suatu gugus fungsi substituen. Akibatnya transisi π→π* pada ikatan ganda terkonjugasi mempunyai puncak absorbsi pada daerah ultraviolet dekat, dengan panjang gelombang lebih besar dari 200 nm. Dengan demikian transisi yang penting dalam penentuan struktur molekul adalah transisi π→π* serta beberapa transisi n→π* dan n→σ*.










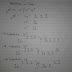


Mengapa Transisi σ ke σ* memerlukan energi paling besar, sedangkan energi terkecil diperlukan untuk transisi dari n ke π?
BalasHapusTerimakasih saudara masbun jawaban nya mudah dimengerti saya hanya ingin sedikit menambahkan pada soal nomor dua tentang Bagian molekul yang bertanggung jawab terhadap transisi tersebut disebut Kromofor.
BalasHapusKromofor yang paling sederhana adalah ikatan jenuh yang berikatan oleh tansisi s – s*, dan mempunyai energi yang tinggi sehingga hanya teramati pada daerah uv vakum (l < 190 nm).
Contoh : Metana dan etana
Semua senyawa organik mampu mengabsorbsi cahaya sebab semua senyawa organik mengandung elektron valensi yang dapat dieksitasi ke tingkat energi yang lebih besar / tinggi. Oleh karena itu penyelidikan untuk senyawa organik dilakukan pada UV lebih besar 185 nm. Hal ini disebabkan apabila <185 nm komponen-komponen atmosfer akan mengabsorbsi secara kuat.
jawaban sudah cukup baik dan membuat saya mengerti
BalasHapussaya ingin menambahkan sedikit tentang teori bohr yg tidak dapat dibenarkan karena teori bohr memiliki kelemahn yaitu :
Bohr hanya dapat menjelaskan spektrum gas hidrogen, tidak dapat menjelaskan spektrum dari unsur yang jumlah elektronnya lebih dari satu.
Tidak dapat menjelaskan adanya garis-garis halus pada spektrum gas hidrogen.
maaf kepada saudari yasni jawabannya masih belom ketemu mungkin kasih saya wakktu untuk mencari refensi dulu beberapa hari kedepan
BalasHapus