A.Sifat gelombang
Pada tahun 1924, Louis de Broglie, seorang ahli fisika dari prancis mengemukakan hipotesis
tentang gelombang materi. Gagasan ini adalah timbal balik daripada gagasan
partikel cahaya yang dikemukakan Max Planck. Louis de Broglie meneliti
keberadaan gelombang melalui eksperimen difraksi berkas elektron. Dari hasil
penelitiannya inilah diusulkan “materi mempunyai sifat gelombang di samping
partikel”, yang dikenal dengan prinsip dualitas.
Sifat partikel dan gelombang suatu materi tidak
tampak sekaligus, sifat yang tampak jelas tergantung pada perbandingan panjang
gelombang de Broglie dengan dimensinya serta dimensi sesuatu yang berinteraksi
dengannya. Pertikel yang bergerak memiliki sifat gelombang. Fakta yang
mendukung teori ini adalah petir dan kilat. Kilat akan lebih dulu terjadi
daripada petir. Kilat menunjukan sifat gelombang berbentuk cahaya, sedangkan
petir menunjukan sifat pertikel berbentuk suara.
Louis Victor de Broglie : menyatakan bahwa materi
mempunyai dualisme sifat yaitu sebagai materi dan sebagai gelombang .\- asas ketidakpastian menurut Werner Heisenberg
eksperimen dirancang untuk menentukan posisi,elektron, maka ketidakpastian momentum elektron akan semakin besar (penentuan momentum menjadi tidak akurat). Jika suatu eksperimen dirancang untuk menentukan momentum elektron, maka ketidakpastian posisi elektron akan semakin besar (penentuan posisi menjadi tidak akurat). Hal ini dapat diatasi jika pengamatan dilakukan oleh 2 orang secara bersamaan.
- teori atom modern oleh Erwin Schrodinger
Daerah ruang di sekitar inti dengan kebolehjadian untuk mendapatkan elektron disebut orbital. Bentuk dan tingkat energi orbital dirumuskan oleh Erwin Schrodinger.Erwin Schrodinger memecahkan suatu persamaan untuk mendapatkan fungsi gelombang untuk menggambarkan batas kemungkinan ditemukannya elektron dalam tiga dimensi.
Persamaan Schrodinger......
| x,y dan z Y mђ E V | = Posisi dalam tiga dimensi = Fungsi gelombang = massa = h/2p dimana h = konstanta plank dan p = 3,14 = Energi total = Energi potensial
Model atom dengan orbital lintasan elektron ini disebut model atom modern atau model atom mekanika kuantum yang berlaku sampai saat ini, seperti terlihat pada gambar berikut ini.
|
Awan elektron disekitar inti menunjukan tempat kebolehjadian elektron. Orbital menggambarkan tingkat energi elektron. Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk sub kulit. Beberapa sub kulit bergabung membentuk kulit.Dengan demikian kulit terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital. Walaupun posisi kulitnya sama tetapi posisi orbitalnya belum tentu sama.
CIRI KHAS MODEL ATOM MEKANIKA GELOMBANG
- Gerakan elektron memiliki sifat gelombang, sehingga lintasannya (orbitnya) tidak stasioner seperti model Bohr, tetapi mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital (bentuk tiga dimensi darikebolehjadian paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom)
- Bentuk dan ukuran orbital bergantung pada harga dari ketiga bilangan kuantumnya. (Elektron yang menempati orbital dinyatakan dalam bilangan kuantum tersebut)
- Posisi elektron sejauh 0,529 Amstrong dari inti H menurut Bohr bukannya sesuatu yang pasti, tetapi bolehjadi merupakan peluang terbesar ditemukannya elektron
B.ORBITAL IKATAN DAN ANTI IKATAN
- Istilah orde ikatan (bonding order) ini digunakan dalam teori orbital molekul (molecule orbital theory). Menurut teori orbital molekul bahwa semua elektron dalam tiap atom dalam molekul turut terlibat dalam pembentukan ikatan dengan mengisi orbital-orbital, yaitu orbital molekul ikatan (bonding molecule orbital) dan orbital molekul antiikatan (antibonding molecule orbital). Berbeda dengan teori ikatan valensi bahwa dalam pembentukan ikatan antaratom hanya elektron valensi saja. Bagaimana menentukan orde ikatan suatu molekul atau ion?
Biasanya menentukan orde ikatan suatu molekul atau ion menggunakan rumus ½ dari selisih jumlah elektron dalam orbital molekul ikatan dengan jumlah elektron dalam orbital molekul antiikatan (ditandai dengan *). Tentu saja perlu kecermatan untuk menghitung jumlah elektron pada orbital-orbital molekul itu.
diagram orbital molekul O2
Orde ikatan untuk O2 = ½ ( Σ elektron dalam orbital ikatan – Σ elektron dalam orbital anti-ikatan)
Orde ikatan untuk O2 = ½ (6 – 2) = 2.
- Orbital molekul antiikatan memiliki energi yg lebih tinggi dan kestabilan yang lebih rendah dibandingkan orbital-orbital atom pembentuknya.
Di dalam OM menunjukkan permukaan dengan kerapatan elektron tetap/konstan sehingga elektron memiliki kemungkinan untuk berada didalamnya. Sehingga sebuah elektron dalam sebuah OM seperti dalam gambar akan berada dalam dalam daerah ikatan. Sebuah elektron dalam orbital ikatan cenderung untuk bersama dalam inti positif, sehingga mengikatnya bersama secara elektrostatik dan meningkatkan kestabilan molekul. Meningkatnya kestabilan berhubungan dengan rendahnya energi, sehingga energi ikatan lebih rendah dibanding energi orbital atom awal (Gambar b). Sebuah elektron pada antiikatan sebagian besar waktunya diluar inti.

Elektron di antiikatan cenderung mengurangi kestabilan molekul dengan menarik inti menjauh. Sebuah elekt+++++ron antiikatan memiliki energi lebih tinggi dibandingkan elektron pada orbital awal. Sehingga Elektron ikatan memiliki energi lebih rendah, sedangkan orbital antiikatan memiliki energi lebih tinggi dibandingkan orbital awal.
- PEMBENTUKAN IKATAN KOVALEN MENGGUNAKAN ORBITAL ASLI
contoh H2S
Dari konfigurasi elektron atom S pada keadaan dasar dapat diketahui bahwa pada orbital 2py dan orbital 2pz masing-masing masih kekurangan satu elektron, demikian pula pada atom H masih kekurangan satu elektron pada orbital 1s. Oleh sebab itu dalam pembentukan H2S, dua elektron yang terletak pada orbital 3p berpasangan dengan dengan dua elektron pada orbital 1s dari dua atom hidrogen.
Besarnya sudut ikatan dua buah orbital p adalah 90°. Berdasarkan eksperimen diperoleh besarnya sudut ikatan H-S-H sebesar 92°. Perbedaan sudut ikatan disebabkan oleh tolakan antara dua inti atom hidrogen yang berdekatan. Karena perbedaan sudut ikatan tidak begitu jauh maka pembentukan ikatan H-S, atom S dianggap menggunakan orbital-orbital asli.
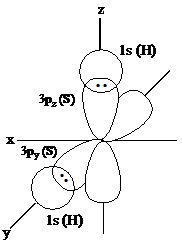 |
| Gambar tumpang tindih orbital-orbital pada pembentukan ikatan H-S dalam molekul H2S.
C.Orbital hibrida karbon
Berikut konfigurasi elektron atom C pada keadaan dasar.

Dari konfigurasi elektron atom karbon pada keadaan dasar diketahui bahwa, jika atom karbon menggunakan orbital asli pada pembentukan ikatan maka hanya terbentuk CH2, yakni tumpang tindih antara orbital 2px dan 2py dari atom karbon dengan 2 orbital 1s dari 2 atom hidrogen. Namun, pada kenyataannya dijumpai lebih stabil CH4 dibanding CH2.
Oleh sebab itu, agar 4 atom hidrogen semuanya berikatan kovalen dengan atom karbon, maka diperlukan 4 buah elektron tidak berpasangan dari atom karbon. Hal ini dapat diperoleh melalui proses eksitasi atau promosi elektron dari keadaan dasar menuju keadaan tereksitasi. Konfigurasi elektron setelah tertjadi eksitasi sebagai berikut.

Setelah tereksitasi, dilanjutkan dengan proses hibridisasi untuk membentuk orbital-orbital hibrid. Berikut konfigurasi elektron setelah terjadi proses hibridisasi.
 Perhatikan, setelah terjadi proses hibridisasi orbital 2s dan 3p dari atom karbon tidak memilki jarak atau pemisahan. Hal ini disebabkan tingkat elektronik kedua orbital tersebut telah setara. Orbital-orbital yang telah mengalami hibridisasi ditulis sebagai 4 orbital hibrida sp3, biasanya hanya disebut sp3. Dengan adanya 4 elektron yang belum berpasangan dari atom karbon, maka CH4 dapat terbentuk melalui tumpang tindih orbital sp3 dengan 4 orbital 1s dari 4 atom H, berikut konfigurasi elektron atom C dalam CH4 dan tumpang tindih orbital-orbital hibrida sp3atom karbon dengan orbital 1s atom hidrogen ditunjukan pada Gambar dibawah ini ...   Gambar Tumpang tindih 4 orbital hibrida sp3 dari atom C dengan 4 orbital 1s dari 4 atom H. |
HIBRIDISASI OKSIGEN DAN
NITROGEN
Dalam diagram orbital, nitrogen dapat menghibridisasi
keempat orbital atom tingkat kedua mejadi empat orbital ikatan sp 3yang ekuivalen.Nitrogen memiliki
tiga elektro tak berpasangan pada orbital hibrid sp 3 , ketika satu elektron
dalam orbital hibrida tersebut tereksitasi ke orbital p maka terbentuk hibrida
baru, yaitu sp2. Elektron pada orbital p digunakan untuk membentuk ikatan pi.
Jadi, atom nitrogen yang terhibridisasi sp2 memiliki satu ikatan pi yang
digunakan untuk membentuk ikatan rangkap dua, mirip dengan molekul etena.
Apabila elektron yang tereksitasi ke orbital p ada dua maka nitrogen memiliki
kemampuan membentuk dua ikatan atau satu ikatan rangkap tiga (hibridisasi sp).katan kovalen tidak hanya terbentuk
dalam senyawa karbon, tetapi juga dapat dibentuk oleh atom-atrom lain.
Semua ikatan kovalen yang dibentuk oleh unsur-unsur dalam tabel periodik
dapat dijelaskan dengan orbital hibrida. Secara prinsip,
pembentukan hibrida sama dengan pada atom karbon. Sudut ikatan
yang terbentuk adalah 107.3 derajat, mendekati sudut tetrahedral (109.5
derajat). Nitrogen memiliki lima elektron pada kulit terluarnya.
Elektron pada ground-state atom oksigen memiliki
konfigurasi:
1s2 2s2 2px2 2py1 2pz1, dan oksigen merupakan atom divalen. Dengan
melihat konfigurasi elektronnya, dapat diprediksi bahwa oksigen mampu
membentuk dua ikatan sigma karena pada kulit terluarnya terdapat dua
elektron tak berpasangan (2py dan 2pz). Air adalah contoh senyawa yang
mengandung oksigen sp3.
sudut ikatan yang terbentuk sebesar 104.5 derajat
diperkirakan bahwa orbital dengan pasangan elektron bebas menekan sudut
ikatan H-O-H, sehingga sudut yang terbentuk lebih kecil dari sudut ideal
(109.5derajat ), seperti halnya pasangan elektron bebas dalam ammonia
menekan sudut ikatan H-N-H.
|
orbital
hibridisasi oksigen
|
B.ikatan rangkap terkonjugasi
ikatan rangkap konjugasi adalah ikatan rangkap selang-seling dengan ikatan tunggal atau disebut juga elektronnya dapat berpindah-pindah (terdelokalisasi). Ikatan rangkap keadaan yang terjadi dalam senyawa tak jenuh yang didalam nya terdapat dua ikatan tunggal( satu ikatan sigma dan ikatan pi)menghubungkan dua atom.
Ikatan rangkap terkonjugasi ialah ikatan yang kedudukan nya
di selang oleh satu ikatan tunggal seperti -CH=CH-CH=-CH. Pengaturan kembali
electron melalui orbital π, terutama dalam system konjugasi atau senyawa
organic yang atom-atomnya secara kovalen berikatan tunggal dan ganda.
Sistem konjugasi terjadi dalam senyawa organik
yang atom-atomnya
secara kovalen berikatan tunggal dan ganda secara bergantian (C=C-C=C-C) dan
memengaruhi satu sama lainnya membentuk daerah delokalisasi elektron.
Elektron-elektron pada daerah delokalisasi ini bukanlah milik salah satu atom,
melainkan milik keseluruhan sistem konjugasi ini. Contohnya, fenol (C6H5OH
memiliki sistem 6 elektron di atas dan di bawah cincin planarnya sekaligus di
sekitar gugus hidroksil.
C.benzena dan resonansi
Senyawa benzena mempunyai rumus molekul C6H6,
dan termasuk dalam golongan senyawa hidrokarbon aromatik. Nama aromatik
digunakan karena senyawa tersebut berbau harum.dari rumus molekulnya dapat
diketahui bahwa benzena merupakan senyawa tidak jenuh karena tidak memenuhi
rumus CnH2n+2.Bila dibandingkan dengan senyawa hidrokarbon lain yang mengandung
6 buah atom karbon, misalnya heksana (C6H14) dan
sikloheksana (C6H12), maka dapat diduga bahwa benzena
mempunyai derajat ketidakjenuhan yang tinggi. Dengan dasar dugaan tersebut maka
dapat diperkirakan bahwa benzena memiliki ciri-ciri khas seperti yang dimiliki
oleh alkena. Perkiraan tersebut ternyata jauh berbeda dengan kenyataannya,
karena benzena tidak dapat bereaksi seperti alkena (adisi, oksidasi, dan
reduksi).Lebih khusus lagi benzena tidak dapat bereaksi dengan HBr, dan
pereaksi-pereaksi lain yang lazimnya dapat bereaksi dengan alkena. Sifat-sifat
kimia yang diperlihatkan oleh benzena memberi petunjuk bahwa senyawa tersebut
memang tidak segolongan dengan alkena ataupun sikloalkena.Benzena dengan gugus
alkil sebagai substituen, diklasifikasikan sebagai golongan arena.
Penataan nama arena dibagi ke dalam dua golongan berdasarkan panjang rantai
alkil. Jika gugus alkil berukuran kecil (atom C6) maka gugus alkil
diambil sebagai substituen dan benzena sebagai induknya.
Resonansi ,Metana (CH4) dan etilena
(CH2=CH2) adalah
contoh dari senyawa organic dengan struktur yang menggunakan garis untuk ikatan
pasangan electron). Suatu garis yang menghubungkan dua lambang atom menyatakan
ikatan kovalen antara dua atom.
Benzene adalah contoh suatu senyawa organic
yang tidak dapat digambarkan secara pasti oleh rumus ikatan valensi tunggal.
edua rumus ikatan valensi untuk benzene ini
disebut rumusKekule yang dicetus oleh Friedrich August kekule pada
tahun 1972. Menurut Kekule, kedua struktur dari benzene bergeser maju mundur
dengan cepat, sehingga tidak ada yang dapat diisolasi secara detail satu per
satu.
Kedua struktur Kekule dikatakan ada dalam resonansi
satu dengan yang lain, alasan inilah yang membuat struktur Kekule
disebut sebagai lambangresonansi atau strukturresonansi untuk benzene.
Struktur benzene merupakan komposit dari dua
struktur resonansi. Jadi, dapat disimpulkan bahwa benzene adalah hibrida
resonansi dari dua struktur resonansi.
Bila berbagai struktur resonansi dapat ditulis
untuk suatu senyawa, maka dapat dibandingkan delokasi dari kerapatan electron.













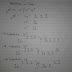


jelaskan maksud dari benzene adalah hibrida resonansi dari dua struktur resonansi?
BalasHapuspada pokok bahasan hibridisasi oksigen dan nitrogen menurut saya akan lebih baik jika di tambahkan gambar yang menunjukkan hibridisasi oksigen dan nitrogen agar lebih mudah dipahami. terima kasih.
BalasHapusapakah masih ada penyebab lainnya setelah terjadi proses hibridisasi orbital 2s dan 3p dari atom karbon tidak memilki jarak atau pemisahan ?
BalasHapusmateri yang anda berikan sudah sangat Bagus namun sedikit ingin menanyakan,Mengapa Orbital molekul anti ikatan memiliki energi yg lebih tinggi dan kestabilan yang lebih rendah dibandingkan orbital-orbital atom pembentuknya?
BalasHapusselamat pagi masbun saya ingin menambahkan pada sifat gelombang.
BalasHapusMula-mula akan dimulai dengan beberapa gelombang diam yang sederhana Jenis gelombang yang dihasilkan bila orang memiliki senar, seperti sinar gitar, yang kedua ujungnya mati. Jenis gelombang ini menunjukkan gerak hanya dalam satu dimensi. Gelombang diam yang disebabkan oleh pemukulan kepala drum adalah berdimensi dua, dan gelombang elektron adalah berdemensi tiga. Tinggi gelombang diam adalah amplitudonya, yang dapat mengarah keatas (+) dan kebawah (-) terhadap kedudukan istirahat dari senar. Kedudukan pada gelombang yang ampitudonya nol disebut simpul, dan sesuai dengan kedudukan yang ada pada senar gitar yang tak begerak bila senar begetar.
Dua gelombang diam dapat sefase atau keluar fase yang satu terhadap yang lain. bila dua gelombang yang sefase pada senar yang saling tumpang tindih, mereka saling memperkuat. Perkuatan dinyatakan oleh penambahan fungsi matematik yang sama tandanya yang menggambarkan gelombang. Sebaliknya sepasang gelombang yang tumpang tindih yang keluar fase, saling menggamggu atau berinterferensi. terima kasih