Tinjauan ulang tentang atom dan molekul dalam kimia organik
Istilah senyawa
organik muncul dari adanya pandangan yg dianut
pada masa lalu, yaitu bahwa senyawa2 kimia dapat dibedakan menjadi
dua golongan besar. Yaitu senyawa berasal dari makhluk hidup (organisme) maka
senyawa tersebut dikatagorikan sebagai senyawa organik. Sedangkan yang
diperoleh dari mineral (benda mati) dikatagorikan sebagai senyawa anorganik.
Dengan dasar pandangan semacam itu jelaslah bahwa yg diartikan dengan kimia
organik pada masa itu adalah cabang ilmu kimia yg mengkaji senyawa2
yg dihasilkan oleh makhluk hidup atau organisme.
 Pengertian senyawa organik seperti di atas hanya
berlaku sampai pertengahan abad ke 19, karena pandangan yg dilandasi oleh
keyakinan adanya “daya hidup” (vital force atau vis vitalis) yg memungkinkan terbentuknya senyawa organik ternyata semakin di ragukan
kebenarannya. Dalam sejarah perkembangan kimia organik tecatat suatu
peristiwa penting pada tahun 1828 yg ditandai oleh keberhasilan Wohler dalam
mensintesis urea (senyawa organik) dari amonium sianat (senyawa anorganik).
Pengertian senyawa organik seperti di atas hanya
berlaku sampai pertengahan abad ke 19, karena pandangan yg dilandasi oleh
keyakinan adanya “daya hidup” (vital force atau vis vitalis) yg memungkinkan terbentuknya senyawa organik ternyata semakin di ragukan
kebenarannya. Dalam sejarah perkembangan kimia organik tecatat suatu
peristiwa penting pada tahun 1828 yg ditandai oleh keberhasilan Wohler dalam
mensintesis urea (senyawa organik) dari amonium sianat (senyawa anorganik).
A.struktrur elektron dari atom
Dalam
Kimia Organik ada 4 unsur yang harus dimengerti atau dipahami
diantaranaya adalah C (carbon), H (Hidrogen), O (Oksigen) dan N (Nitrogen).
Keempat unsur ini ada di kedua periode pertama dari susunan dan elektronnya
terdapat dalam dua kulit eyang paling dekat dengan inti. Konfigurasi elektron dalam atom menggambarkan lokasi semua
elektron menurut orbital-orbital yang ditempati.
Atom mengandung sebuah nukleus (inti) kecil yang
padat yang dikelilingi elektron-elektron. Inti ini bermuatan positif dan
merupakan sebagian besar dari massa atom tersebut. Inti terdiri atas jumlah
proton, yang bermuatan positif, dan neutron yang netral. (pengecualian
satu-satunya ialah hidrogen, yang intinya hanya memiliki satu proton). Dalam
atom netral, muatan positif tepat diimbangi oleh muatan negatif dari elektron
yang mengelilinginya. Nomor atom (atomic number) suatu unsur senyawa organik sama dengan jumlah
proton didalam inti (dan dengan jumlah elektron di sekitar inti dalam atom
netral). Bobot atom (atomic weight) kira-kira sama dengan jumlah proton dan
jumlah neutron di dalam inti, bobot elektron tidak diperhitungkan karena
ringannya.
Tabel1.1
jumlah orbital dan elektron dalam tiga kulit pertama
Nomor kulit
|
Jumlah orbital disetiap jenis
|
Jumlah elektron jika kulit penuh
|
||
s
|
p
|
d
|
||
1
|
1
|
0
|
0
|
2
|
2
|
1
|
3
|
0
|
8
|
3
|
1
|
3
|
5
|
18
|
Elektron
terpusat di kawasan tertentu di ruang sekitar inti yang dinamakan orbital.
Setiap orbital dapat menampung tidak lebih dari 2 elektron. Orbital, yang
bentuknya berbeda–beda, di tandai dengan huruf s, p, dan d. Selain itu,
orbital dikelompokkan dalam kulit (shell) yang diberi nomor 1,2,3 dst. Setiap
kulit mengandung jenis dan jumlah orbital yg berbeda-beda, bergantung pada
nomor kulitnya. Misalnya, kulit 1 hanya mengandung satu jenis orbital, disebut
dengan orbital 1s.
B.Jari-jari atom dan keelektronegatifan
- Jari-jari atom merupakan jarak elaktron terluar ke inti atom dan menunjukan ukuran suatu atom. Jari-jari atom sukar diukur sehingga pengukuran jari-jari atom dilakukan dengan cara mengukur jarak inti antar dua atom yang berikatan sesamanya.
 |
| JARI-JARI ATOM |
Dalam suatu golongan, jari-jari atom semakin ke
atas cenderung semakin kecil. Hal ini terjadi karena semakin ke atas, kulit
elektron semakin kecil. Dalam suatu periode, semakin ke kanan jari-jari atom
cenderung semakin kecil. Hal ini terjadi karena semakin ke kanan jumlah proton
dan jumlah elektron semakin banyak, sedangkan jumlah kulit terluar yang terisi
elekteron tetap sama sehingga tarikan inti terhadap elektron terluar semakin
kuat.
- Keelektronegatifan adalah kecenderungan suatu atom untuk bermuatan negatif atau untuk menangkap elektron dari atom lain. Besarnya keelektronegatifan dapat diukur dengan menggunakan skala Pauling. Harga skala Pauling berkisar antara 0,7 – 4,0.Skala Pauling adalah skala yang dikenalkan pertama sekali tahun 1932, dan merupakan skala yang paling sering digunakan dalam pengukuran elektronegativitas suatu unsur. Fluor (unsur yang paling elektronegatif) diberikan skala Pauling dengan harga 4.0, dan harganya menurun sampai cesium dan fransium yang setidaknya hanya memiliki elektronegatifitas pada skala 0.7
 | ||||
| KEELEKTRONEGATIFAN |
C.Panjang ikatan dan sudut ikatan
- Panjang ikatan merupakan jarak antara inti atom yang satu dengan inti atom yang lain yang berikatan dengannya. Panjang ikatan dipengaruhi oleh keelektronegativan masing-masing atom, semakin kecil perbedaan keelektronegatifan maka panjang ikatan akan semakin besar. Jadi, panjang ikatan berbanding terbalik dengan keelektronegativan antara dua atom. Panjang ikatan juga dipengaruhi oleh jari-jari atom penyusun ikatan, semakin panjang jari-jari atom yang berikatan dalam suatu molekul maka panjang ikatan akan semakin besar. Jadi, panjang ikatan berbanding lurus dengan jari-jari suatu unsur.
- sudut Ikatan ,Bila ada lebih dari duaatom dalam molekul, ikatan membentuk sudut, yang disebut sudut ikatan. Sudut ikatan bervriasi antara 60° sampai 180°.
Kebanyakan struktur organik
mengandung lebih dari tiga atom, dan lebih bersifat berdimensi-tiga, daripada
berdimensi-dua. rumus struktur yang terdahulu untuk amoniak (NH3)
menggambarkan satu teknik untuk menyatakan suatu struktur dimensi-tiga. Ikatan
garis (¾) menyatakan ikatan dalam bidang kertas.
Baji padat ( ¾ ) menyatakan suatu ikatan yang keluar dari
kertas menuju ke pengamat; H pada ujung yang lebar dari baji padat ada dimuka
kertas. Baji yang patah-patah ( ¾ ) menyatakan ikatan yang menunjuk ke
belakang kertas; H pada ujung yang sempit dari baji yang patah-patah ada di
belakang kertas.
D. energi disosiasi
Energi disosiasi ikatan adalah
energi yang diperlukan untuk memutuskan salah satu ikatan 1 mol suatu molekul
gas menjadi gugus – gugus molekul gas.
Contoh
CH4(g) → CH3(g)
+ H(g) ∆H = +425 kJ/mol
CH3(g) → CH2(g)
+ H(g) ∆H = +480 kJ/mol
Reaksi tersebut menunjukan bahwa
untuk memutuskan sebuah ikatan C – H dari molekul CH4 menjadi gugus
CH3 dan atom gas H diperlukan energi sebesar 425 kJ/mol, tetapi pada
pemutusan C – H pada gugus CH3 menjadi gugus CH2 dan
sebuah atom gas H diperlukan energi yang lebih besar, yaitu 480 kJ/mol. Jadi
meskipun jenis ikatannya sama tetapi dari gugus yang berbeda diperlukan energi
yang berbeda pula.
Selain dapat digunakan sebagai
informasi kestabilan suatu molekul, harga energi disosiasi ikatan
dapat digunakan untuk memperkirakan harga perubahan entalpi suatu
reaksi. Perubahan entalpi merupakan selisih dari energi yang
digunakan untuk memutuskan ikatan dengan energi yang terjadi dari
penggabungan ikatan.
ΣH = Σ Energi ikatan pereaksi – Σ
Energi ikatan hasil reaksi
Berdasarkan
banyaknya atom yang ada pada molekul, energi disosiasi ikatan dibagi
menjadi energi disosiasi ikatan molekul diatom dan energi disosiasi
ikatan molekul poliatom.
E.asam dan basa kimia organik
- Asam Lewis adalah zat yang dapat menerima sepasang elektron. Setiap spesies dengan atom yang kekurangan elektron yang dapat berfungsi sebagai asam Lewis, misalnya H+ adalah asam lewis. Kebanyakan asam Lewis selain H+ yang dijumpai dalam buku ini adalah garam logam anhidrat ( ZnCl2, FeCl3, dan AlBr3). Basa Lewis adalah zat yang dapat memberikan sepasang elektron. Contoh NH3 dan OH-, masing-masing mempunyai sepasang elektron valensi yang menyendiri yang dapat disumbangkan ke H+ atau asam Lewis lainnya.
- Asam dan Basa bronsted lowry
Menurut konsep Bronsted Lowry mengenai asam dan basa adalah zat yang dapat memberikan ion hidrogen yang bermuatan positif (H+) contohnya HCl dan HNO3. Basa adalah zat yang dapat menerima H+ contohnya adalah OH- dan NH3.· Asam dan Basa Kuat dan LemahAsam kuat adalah asam yang pada dasarnya mengalami disosiasi sempurna dalam air. Asam kuat yang representatif adalah HCl, HNO3, H2SO4. Ionisasi dari asam-asam kuat ini adalah reaksi asam basa yang khas. Asam HCl misalnya memberikan proton kepada basa H2O. Kesetimbangan terletak jauh ke kanan (ionisasi sempurna dari HCl) karena H2O merupakan asam lebih kuat daripada H3O+. Asam lemah hanya terionisasi sebagian dalam air. Asam karbonat adalah asam anorganik lemah yang khas. Kesetimbangan letaknya jauh ke kiri karena H3O+ adalah asam yang lebih kuat dan HCO3- adalah basa yang lebih kuat.· Asam dan Basa KonjugatKonsep asam dan basa konjugat berguna untuk membandingkan keasaman dan kebasaan. Basa konjugat dari asam adalah ion atau molekul yang dihasilkan setelah kehilangan H+ dari asamnya. Misalnya ion klorida adalah basa konjugat dari HCl. Asam konjugat dari NH3 adalah NH4+. Jika suatu asam itu kuat, maka konjugatnya lemah. dan bila asam lemah atau sangat lemah, basa konjugatnya adalah sedang kuatnya atau kuat, bergantung pada afinitas basa konjugat untuk H+. Jika kekuatan asam dari deret senyawa bertambah, kekuatan basa dari basa konjugatnya berkurang.
- Tetapan Keasaman Suatu reaksi kimia mempunyai tetapan kesetimbangan K yang menggambarkan seberapa jauh reaksi berlangsung sampai berkesudahan. Untuk ionisasi dari suatu asam dalam air, tetapan ini disebut tetapan keasaman Ka.
- Tetapan Kebasaan
Reaksi reversibel dari basa lemag dengan air, seperti reaksi dari asam lemah dengan air, menghasilkan konsentrasi ion yang kecil, tetapi tetap pada kesetimbangan. Tetapan kebasaan Kb adalah tetapan kesetimbangan untuk reaksi ini. Seperti dalam hal Ka, nilai[ H2O ] tercakup dalam Kb dalam ungkapan kesetimbangan.












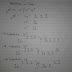


Blog anda sudah bagus tapi pada asam dan basa organik masih belum lengkap untuk reaksi-reaksi yg terjadi, mohon untuk lebih dilengkapi lagi.
BalasHapusInformasi anda sangat bermanfaat. Tapi saya ingat bertanya, jika suatu atom cenderung memiliki kelektronegatifan yang besar atau cenderung menangkap elektron, apakah energi dari suatu atom tersebut akan semakin berkurang? Terimakasih
BalasHapusresume yang menarik. saya ingin bertanya mengapa keelektronegativan dapat mempengaruhi panjang lintasan?
BalasHapusterimakasih
Blog anda sudah Bagus, tetapi saya ingin anda jelaskan secara rinci energi disosiasi molekul diatom dan energi disosiasi ikatan molekul poliatom? Terimaksih
BalasHapus